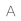【神经康复科病例分享】青少年腓骨肌萎缩症1A型的诊疗及康复
病史摘要
患者女,17岁,因“进行性四肢无力10年、感觉减退3年”于2021年6月1日入我院神经康复科。
患者8岁时无诱因蹲下站起困难,渐影响行走,表现为无力、双足跟难着地,无肉跳,无饮水呛咳。当地医院诊断“脑性瘫痪并跟腱挛缩、双侧髋关节脱位”,行“跟腱延长术”,术后仍进行性行走不稳。3年前因“路滑”跌倒住院于北京某三甲医院,查肌电图示“上、下肢周围神经源性损害”,考虑“腓骨肌萎缩症”,基因检测示“轴突型腓骨肌萎缩症阴性”,不明确“腓骨肌萎缩症”,予穿戴动态踝足矫形器,仍行走不稳,且觉双下肢感觉减退、走路踩棉花感,双上肢无力并感觉减退,手指伸直困难,学业中断,多处诊疗,四肢症状渐加重,半年余前开始依赖轮椅转移。为明确诊断及康复治疗来我院就诊,门诊以“腓骨肌萎缩症?”收入神经康复科。起病以来,神清,精神可,睡眠可,夜间睡眠有打鼾、无憋醒,饮食一般,小便正常,大便规律,1年前开始大便糊状,近3年体重从60kg增加至87kg。
既往史:2015年检查发现“丙氨酸氨基转移酶97.9U/L,天门冬氨酸氨基转移酶42.2U/L”,一直服用“多烯磷脂酰胆碱胶囊456mg 一天三次”,效果一般,2021-5“丙氨酸氨基转移酶258IU/L、天冬氨酸氨基转移酶114IU/L”,查“甲、乙、丙、戊肝炎病毒为阴性”。2015年检查发现“餐后血糖高,最高13.6mmol/L”,此后住院以查空腹血糖为主,“未见异常”,未处理。
家族史:父亲体健。母亲4岁时蹲下站起无力,当地医院诊断“小儿麻痹症”。有一姐姐,体健,MLPA-CMT1无异常。姨妈足弓高。
查体:体温36.1℃,呼吸20次/分,心率80次/分,血压115/80mmHg。身高165cm,体重87kg,BMI32kg/m²,神清语利,对答切题,颅神经查无异常。全身皮肤偏黑,颈部明显。四肢肌肉无明显萎缩。双侧肩外展、屈肘、伸肘肌力4级,双侧屈腕、伸腕、伸指、并指肌力 3 级,双侧伸指、分指肌力 0 级,双手呈“爪形手”。双侧屈髋、伸膝、足背屈、伸趾肌力0级,双侧踝关节活动受限,跟腱挛缩,呈“弓形足”,余部位关节被动关节活动度基本正常。双手手掌温暖、汗多。双膝以下痛温觉、触觉、震动觉、针刺觉减弱。双手指鼻试验稳准。四肢腱反射未引出,病理征阴性,颈软,脑膜刺激征阴性。
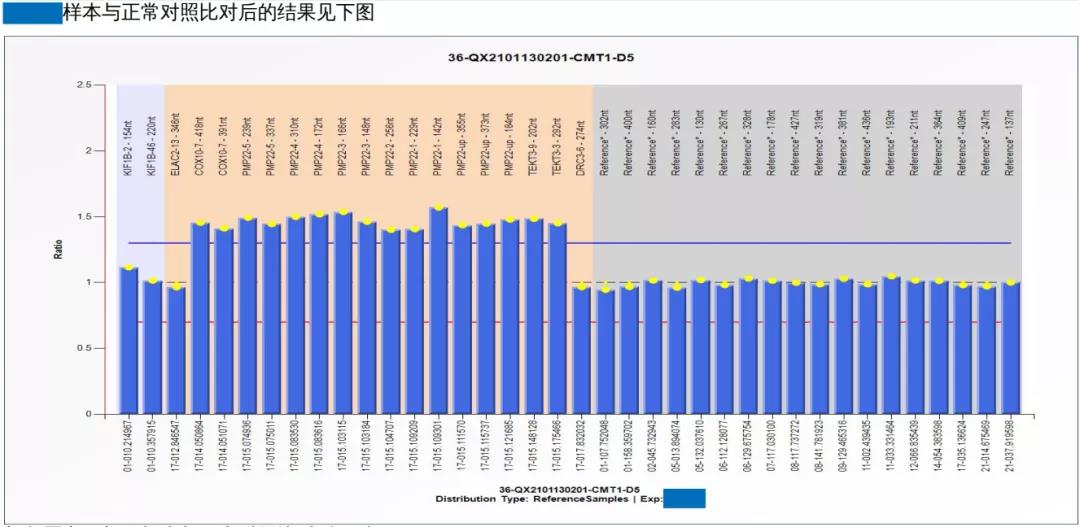
辅助检查:入院查超声示轻度脂肪肝,丙氨酸氨基转移酶269.0U/L、天冬氨酸氨基转移酶130U/L,OGTT试验示糖尿病,胰岛素释放试验示胰岛素抵抗。2021-6-29 MLPA-CMT1基因检测:PMP22基因外显子区域存在全基因重复变异。
临床诊断:
①腓骨肌萎缩症,1A型
②肥胖症
③2型糖尿病
④糖尿病周围神经病变
⑤非酒精性脂肪性肝病
⑥双侧髋关节发育不良
⑦睡眠呼吸暂停低通气综合征(轻度)
临床鉴别诊断:
①慢性炎症性脱髓鞘性多发性神经根病:进行性对称性运动障碍为主,脱髓鞘与轴突变性并存,四肢腱反射消失。母亲及姨妈可能患CMT,倾向于遗传性周围神经病,MLPA-CMT1检查阳性后排除此病。
②POEMS综合征:进行性四肢无力、感觉减退,以下肢远端为主,血糖高、胰岛素抵抗、皮肤颜色改变均支持,住院期间查M蛋白阴性,故排除。
临床康复治疗
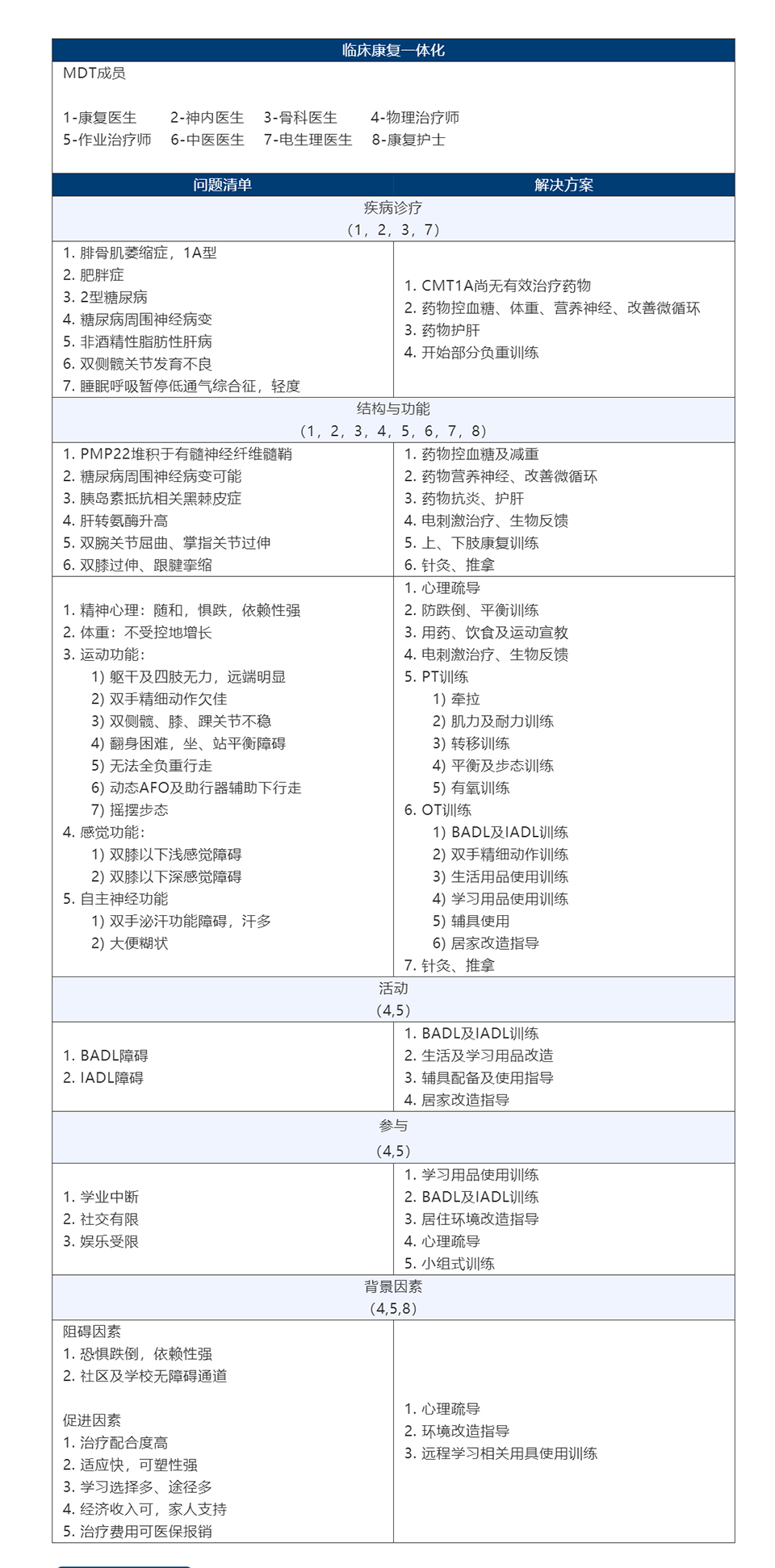
OT治疗过程
粗大防滑笔→一般粗细用笔→不同姿势下使用细小的笔

PT 训练
铰链AFO佩戴、动态平衡训练、天轨辅助下训练。
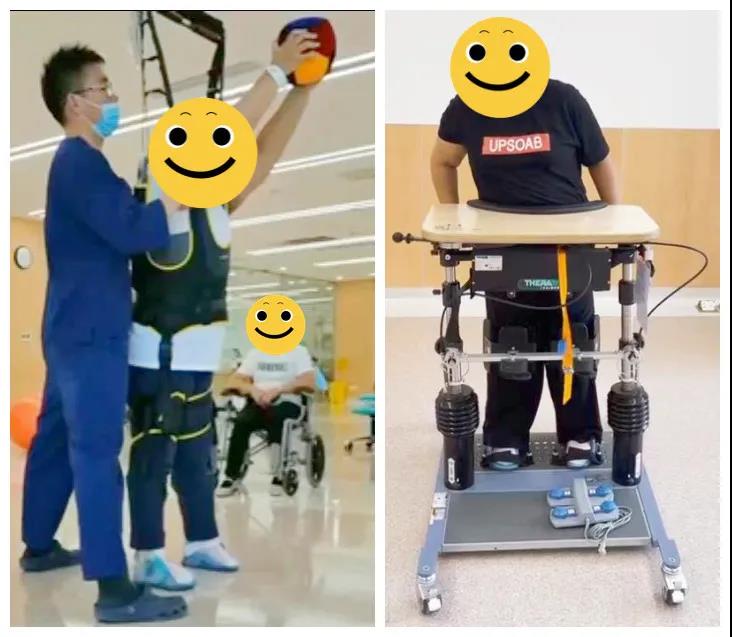
康复评定会掠影
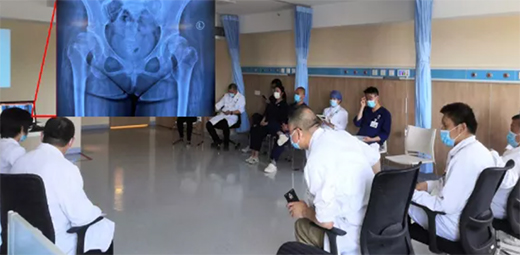
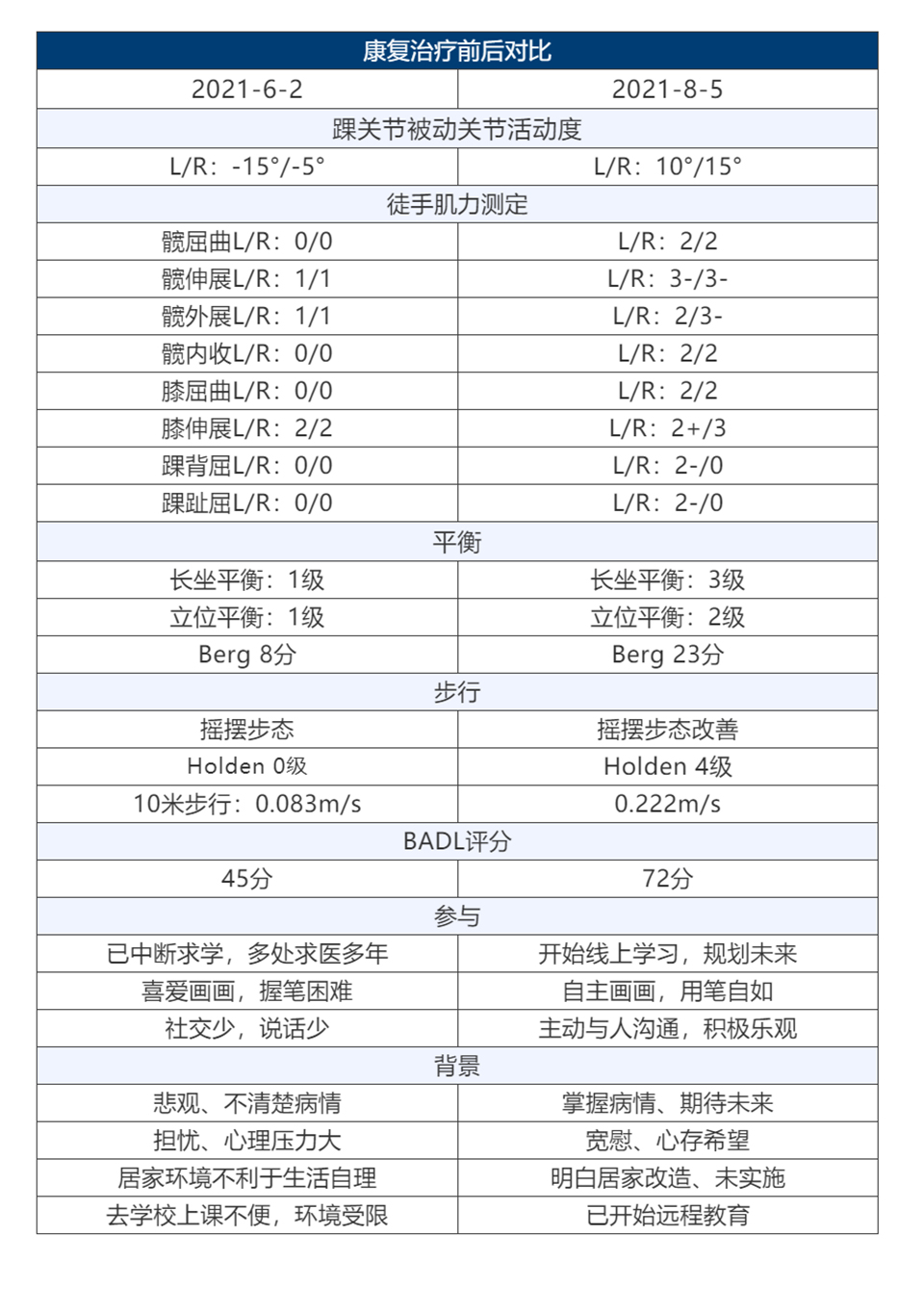
康复前后对比
康复效果
在我院住院康复治疗2个月期间,临床诊断及康复训练方案明确,康复效果显著,如:
· 体重87.0kg→79.8kg;
· 黑棘皮症改善,皮肤较前白,颈部皮肤颜色基本同他处;
· 治疗前餐后血糖最高17.6mmol/L,治疗后5.1-7.0mmol/L;
· 双髋关节发育不良无加重,四肢运动、感觉功能改善明显。
经验总结
1、疾病诊断过程
腓骨肌萎缩症(1A型)(以下称“CMT1A”)是遗传性周围神经病的常见类型,发病率约1/2500,主要分脱髓鞘型(1型)和轴索型(2型)。本患者2021-4-19的NCVs检查示四肢运动感觉神经轴索-脱髓鞘损害,仔细翻阅既往病历资料发现,其首次NCVs检查示四肢周围神经损害以脱髓鞘为主,脱髓鞘病变后可继发轴索损害[1],故考虑为CMT的1型病变,继而精准地完善MLPA-CMT1基因检测,诊断CMT1A。患者在2018年、2021年均曾行CMT相关基因检查,但2018年查的为轴索型病变基因,结果阴性。截至2013年,关于CMT及其相关病变的致病基因已发现有多达70个[2],如目标基因选择错误,即使怀疑CMT,也不一定能通过基因明确诊断。2021年5月再次查CMT相关基因,但检测手段并非国际推荐的MLPA技术,检测结果不完全可靠。
患者数年内体重迅速增长、肝功能损害、血糖高、胰岛素抵抗、黑棘皮症表现,难以用CMT1A解释,且目前关于CMT1A患糖尿病(多为2型)患者的报导中,他们的年龄均为35岁或以上[3],本患者11岁时便发现餐后血糖高,其糖尿病的发生时间较早,完善基因检测排除基因相关糖尿病后,考虑CMT1A后发生的糖尿病。30%活动障碍的儿童和青少年超重或肥胖[4],而肥胖可引起胰岛素抵抗、脂肪肝[5]。
患者曾于2015年检查发现“餐后高血糖”,但此后的住院仅常规查空腹血糖(正常),一直未诊治糖尿病。但中国大多数2性糖尿病患者有餐后高血糖,高达50%的患者仅餐后高血糖。餐后高血糖可增加糖尿病微血管、大血管并发症的发生风险,也可导致胰岛β功能的恶化[6],因此需高度重视单纯性的餐后高血糖。糖尿病及CMT均可引起周围神经病变,但泌汗及大便情况为自主神经功能障碍的表现,难以用CMT解释。且积极管理血糖、改善微循环后周围神经功能明显改善,再次验证糖尿病周围神经病变的诊断。目前,CMT1A引起的周围神经病变难以逆转,但肥胖、糖尿病、糖尿病周围神经病变、脂肪肝等均可通过正确的治疗获得良好效果,对于此类遗传进展性疾病患者,应科学地,积极地康复治疗。
2、CMT1A的康复治疗
当前已有治疗CMT1A的药物进入临床试验第三阶段[7],有效药物研发成功及推广前,康复治疗为最主要的治疗方法[8]。CMT1A的康复训练主要包括牵拉、肌力及耐力训练、平衡功能训练、步态训练等。此外,辅具、用具改良、环境改造也可进一步提高功能,包括AFO、轮椅、使用改良的笔、居家改造等。
3、CMT1A的预后
CMT1A的致病基因如为两倍复制,一般不影响寿命,三倍复制则对寿命影响大[9, 10]。本患者为两倍复制,病程进展缓慢,预后可,且康复治疗效果显著。对于进展性遗传疾病患者,如能科学地、有循证支持地告知患者及家属预后良好可减少患者和家属的焦虑,激发其对抗疾病的信心,提高生活质量。
有效的康复治疗离不开对疾病的认识、多学科的合作。参与本例患者诊断、治疗及康复的医疗人员包括但不限于康复医生、神经内科医生、中医科医生、电生理科医生、治疗师、护士等。我们在为本患者提供临床康复一体化医疗服务的基础上,定期召开初、中、末期康复评价会,共同制定、改善康复治疗方案,共同努力实现功能最大化。
参考文献
1. Pareyson, D. and C.J.T.L.N. Marchesi, Diagnosis, natural history, and management of Charcot–Marie–Tooth disease. 2009. 8(7): p. 654-667.
2. Rossor, A.M., et al., Clinical implications of genetic advances in Charcot–Marie–Tooth disease. 2013. 9(10): p. 562-571.
3. Yu, Z., et al., Characteristics of demyelinating Charcot-Marie-Tooth disease with concurrent diabetes mellitus. 2014. 7(7): p. 4329.
4. Bandini, L.G., et al., Prevalence of overweight in children with developmental disorders in the continuous national health and nutrition examination survey (NHANES) 1999-2002. 2005. 146(6): p. 738-743.
5. Godoy-Matos, A.F., et al., NAFLD as a continuum: from obesity to metabolic syndrome and diabetes. 2020. 12(1): p. 1-20.
6. 母义明,纪立农,杨文英等, 中国 2 型糖尿病患者餐后高血糖管理专家共识. 2016. 24(5): p. 385-392.
7. Boutary, S., et al., Treating PMP22 gene duplication-related Charcot-Marie-Tooth disease: the past, the present and the future. 2021. 227: p. 100-111.
8. Mannil, M., et al., Rehabilitation in Charcot–Marie–Tooth disease type 1. 2014. 14(4): p. 25-27.
9. Liu, P., et al., Mechanism, prevalence, and more severe neuropathy phenotype of the Charcot-Marie-Tooth type 1A triplication. 2014. 94(3): p. 462-469.
10. Thompson, J.M.M. and C.J. Klein. Thirty Years Later, Case Closed: A Case of PMP22 Triplication From Anticipation. in Mayo Clinic Proceedings. 2016. Elsevier.

 400 112 0699
400 112 0699